タンパク質のかたちから探るウェルナー症のしくみ
奈良先端科学技術大学院大学 北 野 健
1. ウェルナー症とWRN ヘリカーゼ
治療法が見付かっていない難病のひとつ,“ウェルナー症候群”は,若い年齢で全身の老化が進行する,常染色体劣性遺伝の疾患です。発症の原因は,ヒトが有する“WRN ヘリカーゼ (Wernersyndrome protein)”というタンパク質が,変異によって機能を失うことによります。
ウェルナー症の患者数は世界で数千人と推定されていますが,実はその7 割を日本人患者が占めていて,実際,日本人の数百人に一人がウェルナー症の保因者,すなわち発症しなくても,WRNヘリカーゼをコードする遺伝子に変異を有すると推定されています。
なぜ日本人の遺伝子に変異が多いのか,その理由もよく分かっていないのですが,しかしそもそもなぜ,WRN ヘリカーゼが機能を失うと,病気が引き起こされてしまうのでしょうか?
ヒトのからだの中には,10万種類ものタンパク質が存在すると言われています。たった1種類のタンパク質が変異しただけで,なぜ重篤な疾患が引き起こされてしまうのでしょうか?
本稿では,WRN の研究から分かってきた発症のしくみについて,ご紹介したいと思います。
2.RecQ ファミリーヘリカーゼ
ウェルナー症の原因タンパク質として知られるWRN ヘリカーゼですが,生物学的には“RecQファミリーヘリカーゼ”とよばれるタンパク質グループに分類されています。
RecQ ファミリーには他にも,“BLM ヘリカーゼ (Bloom syndrome protein)”というタンパク質が含まれているのですが,BLM が変異によって機能を失うと,“ブルーム症候群”というガン多発性の疾患が引き起こされます。
つまりWRN の変異によって発症するウェルナー症候群と,BLM の変異によって発症するブルーム症候群には,病気のしくみに多くの共通点があるようなのです。
3.ヘリカーゼとは?
ウェルナー症とブルーム症のしくみを理解するには,ヘリカーゼというタンパク質の機能に着目する必要があります。
私たちの体内では,日々たくさんの細胞が分裂を繰り返しています。そのおかげで身体の健康が維持されるわけですが,ひとつひとつの細胞が正常に分裂するためには,2 本の遺伝子DNA がねじれ合わさった二重らせん構造がいったんほどかれ,それぞれがコピーされなければなりません。
この際にDNA をほどく (巻き戻す) という重要な作用をするのが,ヘリカーゼとよばれる一群のタンパク質酵素です。
通常,教科書によく載っているヘリカーゼは,ドーナッツ状のかたちをした“複製ヘリカーゼ”とよばれるもので,二重らせんのDNA だけを効率よくほどきます。
ところがWRN ヘリカーゼとBLM ヘリカーゼは,通常の二重らせんに加えて,十字型の“ホリデイジャンクション”とよばれる絡まり構造や,染色体末端を保護している“テロメア”など,入り組んだ形状のDNA 構造までも解きほぐすことができます。
この優れたヘリカーゼ活性こそ,WRN とBLM が私たちの細胞を,早期老化とガン化から守ることができる理由と考えられているのですが,しかしなぜ両タンパク質だけに,そのように高度な巻き戻し作業が可能なのか,しくみは分かっていませんでした。WRN とBLM がDNA をほどく姿を,実際に見た人がいなかったのです。
4.WRNとBLM のドメイン構造
WRN ヘリカーゼは,1,432 個ものアミノ酸が一列に連なってできたマルチドメインタンパク質です (図1)。ドメイン構成はBLM ヘリカーゼも似ています。どちらのタンパク質も,中央にモーターとして働くATPase ドメインがあって,その後ろに,特徴的なふたつの領域,“RQC ドメイン”(RecQ C-terminal の略) と“HRDC ドメイン”が続いています。
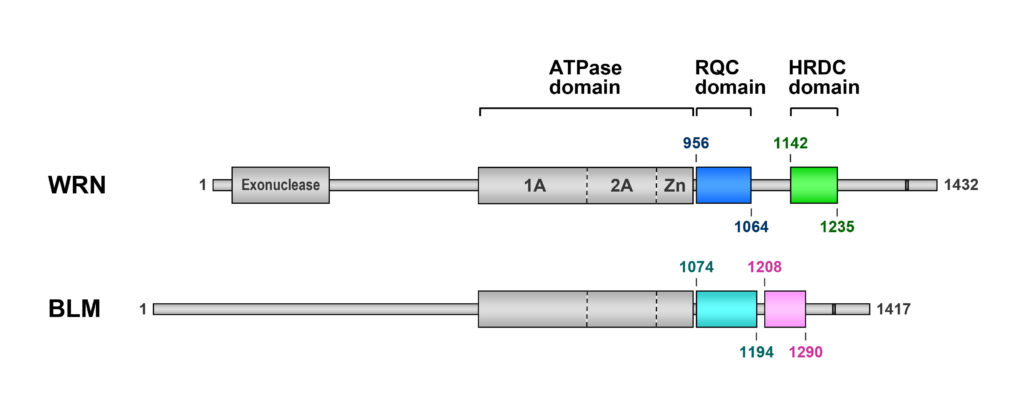
図1 RecQ ファミリーヘリカーゼWRN とBLM のドメイン構成。
後半にRQC ドメイン,HRDC ドメインというふたつの特徴的な領域が存在する。
RQC とHRDC はどちらも珍しいドメインなのですが,特にRQC ドメインのほうは,名前が「RecQ」に因んで命名されたことから分かるように,RecQ ファミリー以外のタンパク質には見つかっていないというほど希有なドメインです。
ということは,もしこのRQC ドメインの中に,RecQ ファミリー特有のヘリカーゼ活性の秘密が隠されているとしたら,病気の発症とつじつまが合うのではないでしょうか?
5.X 線結晶構造解析
私は,WRN ヘリカーゼとBLM ヘリカーゼの機能を,タンパク質のかたち(分子立体構造)から探る研究を行っています。
研究を行う上で軸としているのは,“X線結晶構造解析”とよばれる手法です。この手法では,ヒトのタンパク質を大腸菌を使って大量発現させて,クロマトグラフィーとよばれる装置を使って高純度精製したのち,様々な試薬を加えることで結晶にします。
図2 に,精製したWRN ヘリカーゼRQC ドメインのタンパク質試料 (A),結晶写真 (B),そしてX 線解析後の電子密度3D マップ (C) を載せています。通常,タンパク質の結晶はとても小さく,WRN の結晶も太さが0.05 mm 程しかありません。扱いには高倍率の実体顕微鏡と,細心の注意が必要です。
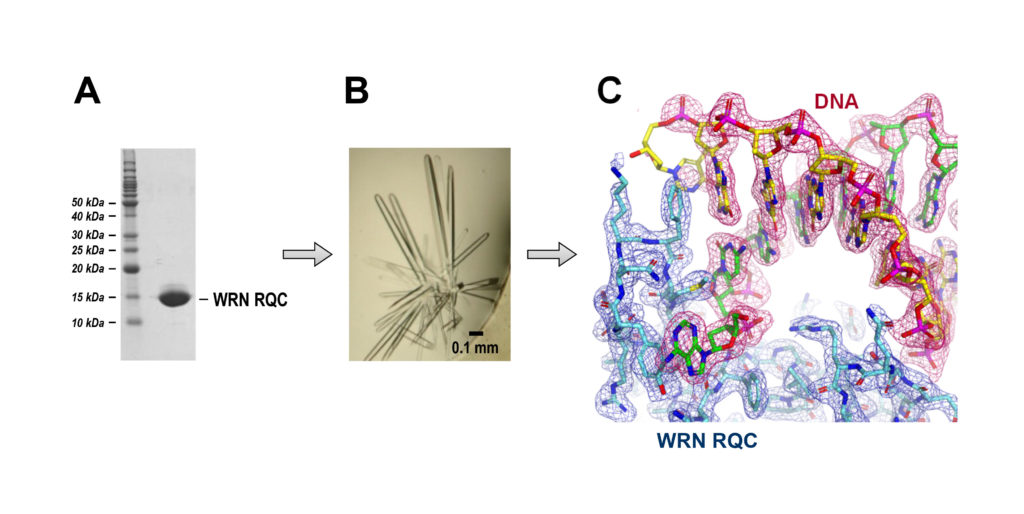
図2 X線結晶構造解析のながれ。
(A) WRN の精製試料。タンパク質を電気泳動法で純度分析したもの。
(B) WRN の結晶。RQC ドメインに二本鎖DNA を加えて結晶化したもの。
(C) WRN の電子密度3D マップ。青色がRQC ドメインで赤色が二本鎖DNA。
作成したタンパク質の結晶は液体窒素中に凍結保存して,放射光施設(兵庫県のスプリング8など)に持っていきます。施設の強力なX線ビームを当てることで,立体構造を決定するためのX 線回折データの収集を行います。
収集したデータを研究室に持ち帰って,コンピュータで様々な計算を行うと,うまくいけば徐々に,タンパク質分子のかたちや,DNA に作用している姿が見えてくるのです。
6.WRN とBLM の立体構造
図3 に,構造決定したWRN とBLM のドメイン立体構造 (計4 個) を示しています。すべての構造データは,プロテインデータバンク (PDB,http://www.rcsb.org) に登録済みなので,誰でも見ることができます。
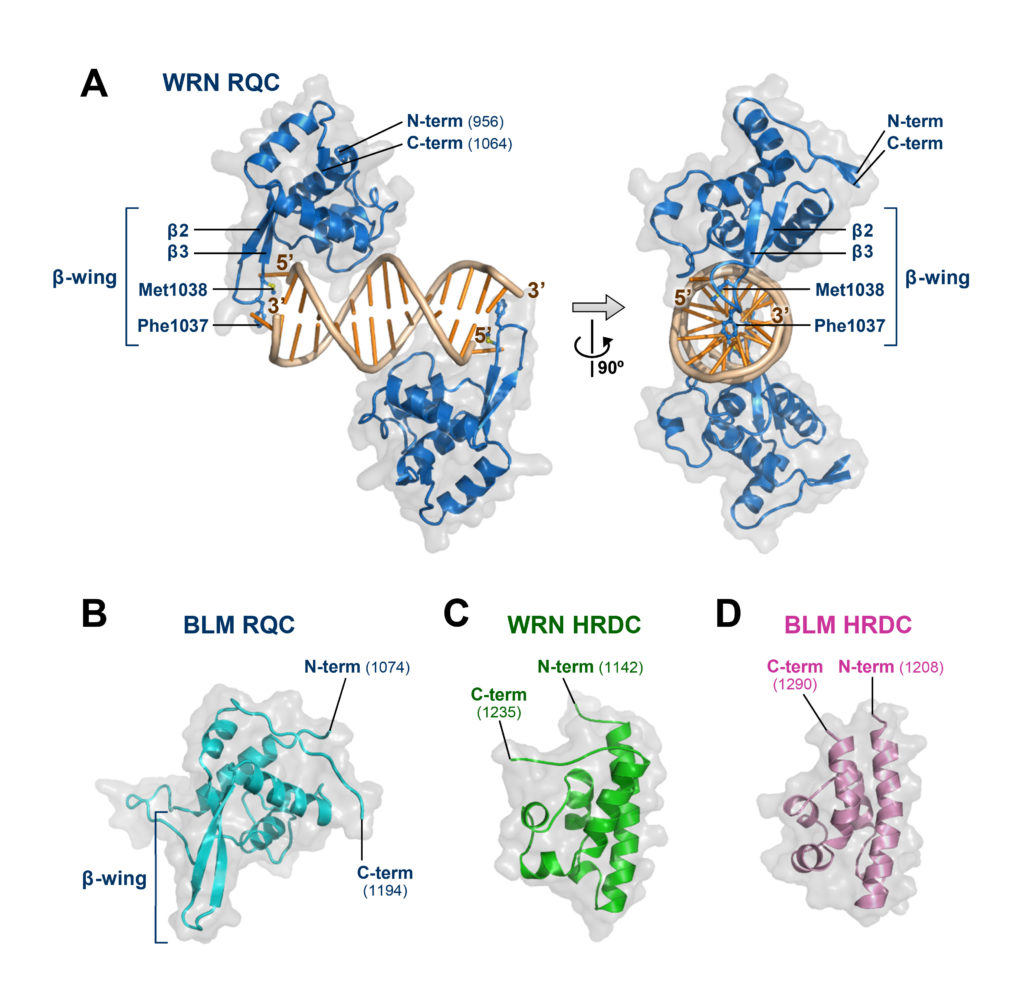
図3 WRN ヘリカーゼとBLM ヘリカーゼのドメイン立体構造。
(A) WRN RQC ドメイン-二本鎖DNA 複合体 (PDB ID:3AAF)。
(B) BLM RQC ドメイン (3WE2,3WE3)。
(C) WRN HRDC ドメイン (2E1E,2E1F)。 (D) BLM HRDC ドメイン (2RRD)。
注目して頂きたいのは,上段 A の構造です。この立体構造を見ると,2 分子のWRN ヘリカーゼRQC ドメインが,DNA 二重らせんの両末端に結合して,それぞれ左と右から,ワトソン・クリック塩基対を1 塩基ずつほどいている様子が確認できます。
つまりこの立体構造では,WRN ヘリカーゼによるDNA の巻き戻しという,まさにその瞬間が結晶化で捉えられていたわけです。RQC ドメインにヘリカーゼ活性の秘密が隠されているという読みは,当たりだったようです。
RQC ドメインは,109 個という少ない数のアミノ酸からできています。WRN 全体のアミノ酸数が1,432 個ですので,実際,ほんの一部分にすぎません。
にもかかわらず,この小さなRQC ドメインは,外部からのエネルギー供給もなしに,二重らせんの1 塩基対を自力でほどいていました。これは他のタンパク質では例のない,大変珍しい現象でした。
7.DNA 巻き戻しのしくみ
ではRQC ドメインによるDNA の巻き戻しと,ウェルナー症の発症には,どのような関係があるのでしょうか?
WRN の立体構造を詳しく調べると,ひとつ興味深いことが分かりました。
RQC ドメインの端に,β-wing とよばれる細長い構造部分 (図4) があるのですが,この突き出したβ-wing が,ちょうどDNA の塩基対に沿って平行に差し込まれることで,巻き戻しを巧妙に触媒していたのです。
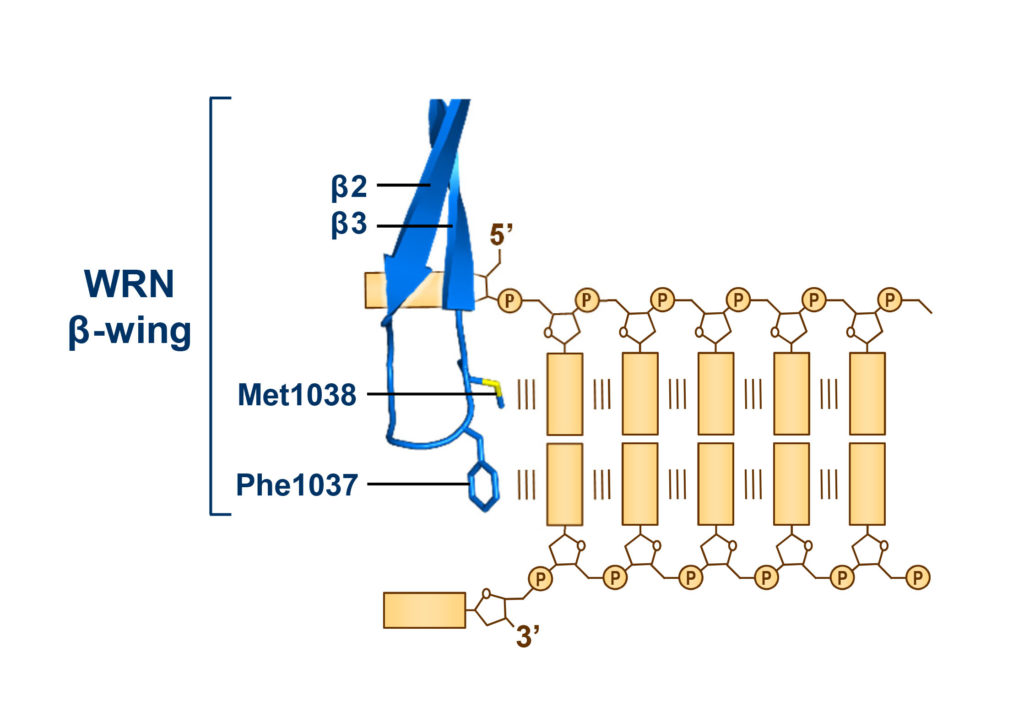
図4 WRN のβ-wing がDNA の巻き戻しを触媒するしくみ。
その仕草はちょうど,メスをつまんだ外科医の手が,DNA 二重らせんを端から二本に切り分けていく様に似ています。実に丁寧なDNA のほどき方で,ドーナッツ形状の複製ヘリカーゼとは全く異なるほどき方です。
では同じくRecQ ファミリーに属する,BLM ヘリカーゼのほどき方はどうなのでしょうか?
BLM の立体構造も,X 線結晶解析で調べてみました。すると案の定,RQC ドメインの端に,WRN のと似た形状のβ-wing が存在することが分かったのです (図3B)。
つまりβ-wing という,尖ったツールを使って行うDNA の巻き戻し,この独特なヘリカーゼ活性のしくみこそ,WRN とBLM が病気の発症を防ぐことができる秘密の正体では,との考えに至ったのです。
8.特殊なDNA 構造の巻き戻し
前述したようにWRN とBLM は,十字型のホリデイジャンクションや染色体末端のテロメアといった,特殊なDNA 構造も解きほぐすことができます。
次に,これらのDNA 構造との複合体結晶を作って,WRN とBLM がより困難な巻き戻しを行う姿も,X 線結晶解析で見たいと考えました。
しかし残念ながら,この試みはうまく行っていません。とても難しい実験で,他にも世界各国の研究者たちが結晶化を試みているのですが,誰も成功していないのです。
そこで私は,かわりにコンピュータを使って,シミュレーション・モデルの構築を進めることにしました。
構築に用いた立体構造は,上述したDNA 巻き戻し中のWRN RQC ドメイン (PDB ID:3AAF),英国のグループが結晶解析した全長に近いBLM ヘリカーゼ (4O3M),そして専用ソフトウェアで作成したホリデイジャンクションの構造モデルです。
これらの構造をコンピュータ上で重ね合わせて,モデリングによる補正作業と構造計算を施すことで,WRN とBLM が特殊なDNA の解きほぐしを行う姿を,具現化できないかと考えました。
9.BLM とホリデイジャンクション
図5 に,得られたシミュレーション・モデルのひとつ (BLM ヘリカーゼ-ホリデイジャンクションDNA 複合体) を示しています。実際にX 線結晶解析したものではないので,あくまでモデルですが,複合体の形成様式は,検証実験の結果ともうまく整合性がとれていて,信頼性が高いモデルと考えています。
この反応モデルでは,十字型のホリデイジャンクションに,2 分子のBLM が,それぞれ左と右から結合しています。
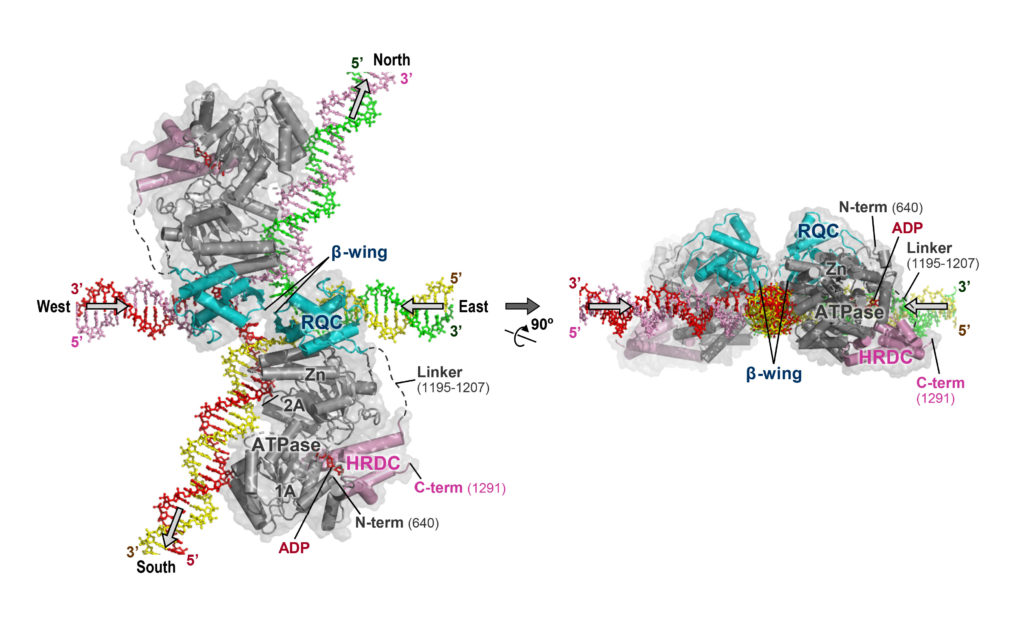
図5 BLM によるホリデイジャンクションの解きほぐし。
コンピュータ上で作成したシミュレーション・モデル。実際の細胞内ではこの絡まりがふたつ並んだ,“ダブルホリデイジャンクション”の解きほぐしが行われる。矢印はDNA 鎖の移動方向。
分かりやすくするために,図6A に模式図で示しました。
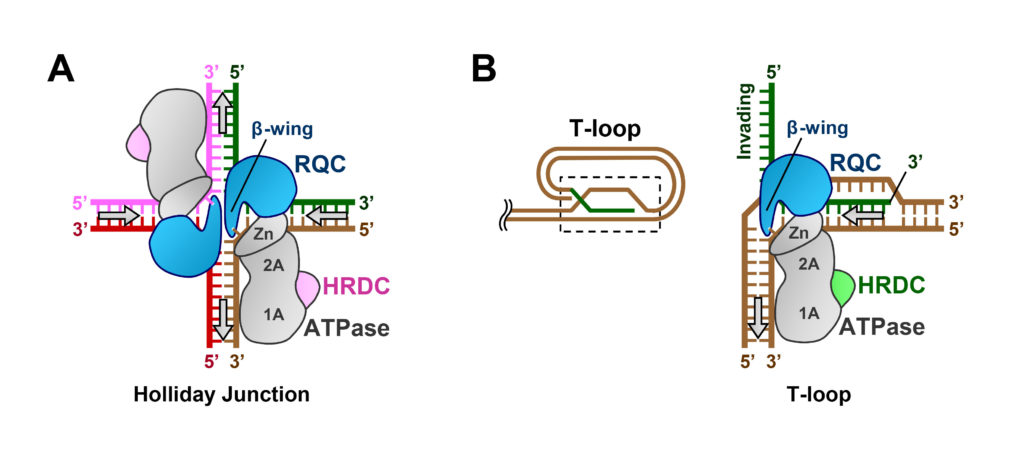
図6 BLM とWRN による特殊なDNA 鎖の解きほぐし。
(A) BLM によるホリデイジャンクションの解きほぐし (図5を模式的に表したもの)。
(B) WRN によるテロメアの解きほぐし (仮想モデル)。T-ループの点線枠内が右図に相当する。
2 分子のBLM は,十字型DNA の中央にある狭い穴に,2 本のメスのような構造 (β-wing) を差し込むことで,それぞれ左と右のDNA を巻き戻そうとしています。
注目して頂きたいのは,2 本のβ-wing が,それぞれのタンパク質分子のちょうど端から突き出していることです。この配置のおかげで,2 分子のBLM ヘリカーゼは互いにぶつかることなく,両側から2 本のβ-wing を同時に差し込むことができるのです。
最近,医学の分野で,ダビンチという外科手術支援ロボットが脚光を浴びています。ダビンチは,小さな切開部に複数のメスや鉗子を同時挿入できる尖った指先と,これらの指先を左右から制御する複数の腕を持っています。BLM によるホリデイジャンクションの解きほぐしは,このロボットの動作に似ているかもしれません。
BLM ヘリカーゼが変異したブルーム症候群の場合,ホリデイジャンクションを解きほぐして修復することができないため,仕方なく十字型DNA が切断された結果,様々なガンが誘発されると考えられます。
10.WRN とテロメア
次にWRN ヘリカーゼですが,実は残念なことに,WRN の細胞内での役割はまだはっきりと突き止められていません。BLM に比べると,研究が世界的に遅れているのです。
ただ多くの研究グループが,一致して重要性を指摘しているDNA 構造があって,それが染色体末端を保護しているテロメアです。
テロメアはその長さが細胞寿命に関係することから,老化時計ともよばれる重要なゲノム部位です。一方で,DNA 複製が特に困難な領域としても知られています。その理由のひとつが,テロメアループ (T-ループ) とよばれる投げ縄のような構造 (図6B) です。
このT-ループを,DNA 複製時に解きほぐしているタンパク質として,WRN ヘリカーゼが有力視されているのです。
図6 で,T-ループの構造 (B) をホリデイジャンクション (A) と見比べてみると,たしかに十字の右半分とよく似ています。T-ループの解きほぐしでも,やはり,メスのような形状のβ-wingが役に立つはずです。
WRNヘリカーゼが変異したウェルナー症候群の場合,T-ループの解きほぐしがうまくいかずに,テロメア長の欠落が進みやすく,早期老化の一因となっている可能性が考えられます。
11.おわりに
WRN ヘリカーゼとBLM ヘリカーゼは,RQC ドメインという独自のドメインの端に,β-wing という尖った巻き戻しツールを進化させました。その結果,他のタンパク質にはアクセスできないDNA のわずかな隙間からでも,巻き戻しを開始できる特殊能力を身に付けたのでしょう。
こんな細かい作業が行える専用タンパク質は,ヒトの細胞には他にないので,WRN とBLM,どちらか一方でも変異して機能しなくなると,ウェルナー症とブルーム症という,重篤な病気が引き起こされてしまうのでしょう。
発症のしくみが,ぼんやりと見えてきたようです。しかし前述のとおり,ウェルナー症の基礎研究は遅れていて,まだ初期段階というのが現状です。解明すべき課題は山積みなのです。
例えば,WRN は,グアニン4 重鎖 (G4 DNA) というさらに困難なテロメア構造もほどくことができます。病気の発症に関わる現象のひとつですが,そのしくみは全く分かっていません。タンパク質のさらなる構造研究が不可欠です。
また実は,WRN ヘリカーゼは最近,難病以外の研究分野でも注目を集めています。一般人に対する新しい抗ガン剤ターゲットとして,WRN が有望であることが実証されたのです。欧米ではすでに,複数のグループがWRN 阻害剤の開発を進めていて,臨床での実用化を目指しています。
ウェルナー症という,まれな疾患の治療法を探るのに重要なWRN ヘリカーゼの研究ですが,いまや,人類全体の健康増進につながる可能性をも秘めているのです。
本研究を進めていくに当たって,(財) 有森記念財団より多大なるご支援を賜りました。こころより感謝申し上げます。
関連資料
[1] Kitano, K. “Structural mechanisms of human RecQ helicases WRN and BLM.” Front. Genet., (2014),5, 366.
[2] 北野 健. “ヒトRecQ ヘリカーゼWRN とBLM の結晶構造解析.” 日本結晶学会誌, (2014),56(2), 133-138.
[3] Kitano, K. “Structural mechanisms of human RecQ helicases WRN and BLM.” (招待講演) 3rd International Meeting on RECQ Helicases in Biology and Medicine (RECQ2016), 2016.05.28-30, Seattle, USA.
